


Il CIO – Collegio Italiano di Osteopatia è centro clinico osteopatico, con un team di professionisti a disposizione dei pazienti dal lunedì al venerdì, e centro di formazione d'eccellenza postgraduate per osteopati e operatori sanitari. L'efficacia della didattica è garantita da docenti altamente referenziati. Non solo osteopati, ma anche medici, ricercatori, scienziati, docenti universitari autori di libri e pubblicazioni autorevoli.
Ci troviamo a Parma in strada Argini Parma,103/b.


Alcuni di loro, oltre a ricevere pazienti, sono impegnati nella ricerca osteopatica e nelle attività di tirocinio rivolte agli studenti di osteopatia.
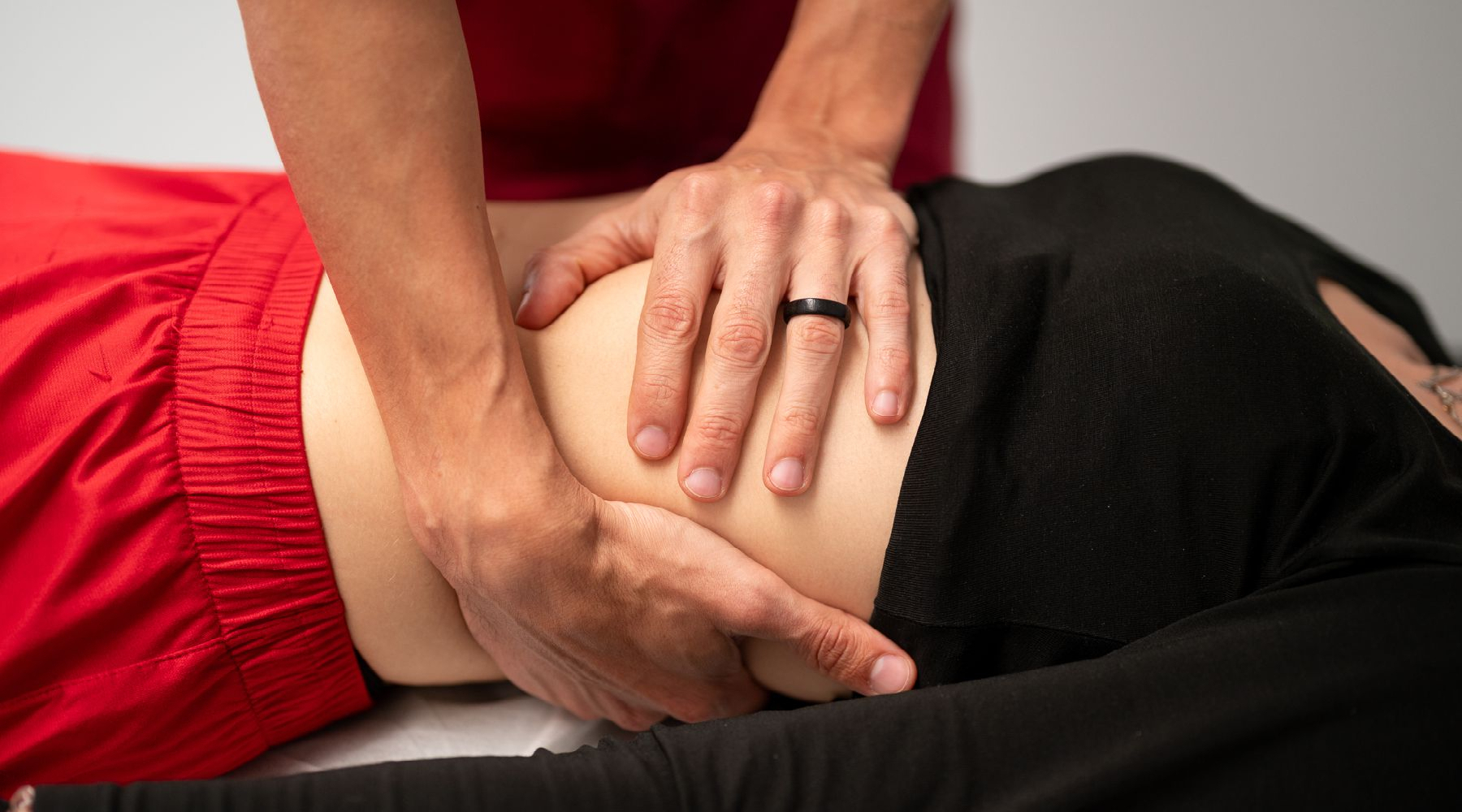
Oltre alle attività cliniche e formative, il CIO è impegnato nella ricerca in ambito osteopatico. Negli anni sono stati condotti numerosi progetti attuati in collaborazione con Facoltà universitarie, aziende ospedaliere, aziende private, e con la Fondazione C.O.ME Collaboration onlus.